Wenn PhysikerInnen Bücher über Molekularbiologie lesen (so wie ich derzeit dann und wann), sollten sie sich wahrscheinlich öfter mal schämen, weil sie Dinge faszinieren, die Menschen krankmachen. Aber andererseits weht ein Geist der Einsicht, wenn makroskopische, fast alltägliche Phänomene atomare Grundlagen haben.
Gerade habe ich etwas über erbliche Hypomagnesiämie gelesen, also einen genetisch bedingten Magnesiummangel, speziell das Meier-Blumberg-Imahorn-Syndrom (und wieder mal haut mich um, dass in der Wikipedia über fast alles etwas steht, auch wenn dieser spezielle Artikel mich gewiss nicht fasziniert hätte).
Wesentliches Symptom dieser Krankheit sind Krämpfe, wie vielleicht erwartbar bei Magnesiummangel; doch können die Betroffenen Magnesium zu sich nehmen, so viel sie wollen, die Krämpfe bleiben. Das liegt daran, dass die Niere ohne weitere Maßnahmen endlos Magnesium verliert und es deshalb im Normalbetrieb fleißig rückresorbiert, es also aus dem in der Produktion befindlichen Urin wieder in den Körper zurückdiffundieren lässt. Ein klarer Hinweis auf eine Störung in dem System: Bei den Betroffenen geht der sehr niedrige Magnesiumspiegel im Blut mit einem sehr hohen Magnesiumspiegel im Urin einher.
Die Rückresorption nun funktioniert bei der erblichen Hypomagnisiämie nicht, weil die Zellen im Nieren-Epithel – also so einer Art innerer Haut, die Blut und Urin trennt – zu fest zusammenkleben. Zellen solcher Epithelien nämlich kleben sich ziemlich weit an der Außenseite („apikal“ – allein die Terminologie begeistert mich ja immer) fest zusammen. „Tight Junction“ heißt das im Englischen und wohl im Wesentlichen auch im Deutschen.
Diese Tight Junctions sehen in verschiedenen Hauttypen jeweils leicht anders aus und können sozusagen gezielt Lücken lassen, je nach dem, wo das Epithel ist und was die Epithelzellen noch so alles tun können und wollen. Im Magen z.B. sollte die apikal (Ha!) schwappende starke Säure wohl besser gar nicht durchkommen, im Darm gehen Natriumionen auch mal an den sortierenden Zellen vorbei direkt ins Blut.
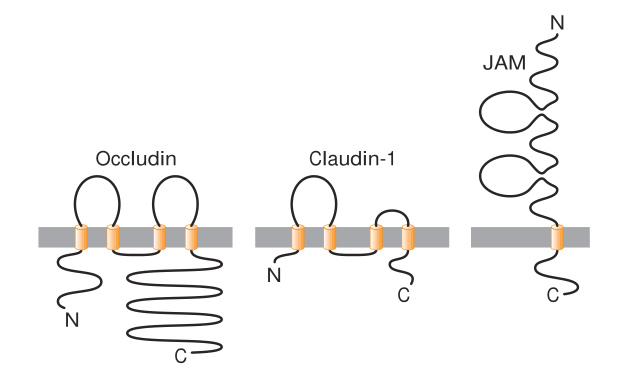
Karikaturen der drei Sorten von Bindungsmolekülen von Tight Junctions. Die dicken grauen Striche sind die Zellmembran, die Klebemoleküle sind als tief in den jeweiligen Zellen verankert, damit das auch ordentlich hält. Aus: Lodish, H. et al: Molecular Cell Biology, 5. Auflage.
In normal funktionierenden Nieren geht die Rückresorption des Magnesiums durch die Tight Junctions, die dafür natürlich die passenden Lücken lassen müssen. Mein Physikherz schließlich schlug höher weil „wir“ (also… „die Menschheit“) ganz gut verstehen, was da molekular passiert. Im Groben machen drei Gruppen von Proteinen das Montagematerial an den Tight Junctions aus: Occludine und Claudine (die im Wesentlichen Schlaufen aus der Zellmembran heraus bilden) sowie antikörperähnliche JAMs („junction adhesion molecules“; ich glaube, die haben es noch nicht in die deutsche Wikipedia geschafft), die im Gegensatz dazu eher lange hakenartige Strukturen bilden.
Die spezifischen Formen dieser Moleküle bestimmen, was durch die Tight Junctions durchkann, wenn sie sich erstmal mit ihren Gegenstücken der Nachbarzellen gefunden haben. Im Fall der erblichen Hypomagnesiämie nun ist sogar klar, welches Molekül genau die Löcher für die Magnesiumionen lässt. Es trägt den vielleicht etwas enttäuschenden Namen Claudin-19, und wir wissen auch, wo das kodierende Gen liegt: Chromosom 1, p34.2. Eine ungünstige Mutation dort, und ihr habt in einem Fort Krämpfe.
Von Muskelkrämpfen zu Atomphysik in ein paar relativ kleinen Schritten: Ich sollte Molekularbiologe werden.
Allerdings: Die Rolle der Claudine wurde mit Knock-out-Mäusen geklärt. Bäh. Das ist ja so schon schlimm genug, aber die Vorstellung, was für Wesen herauskommen, wenn jemand den Zusammenhalt von Epithelien ausschaltet: Oh Grusel. Für mich: Dann doch lieber zurück zu den Sternen.
Zitiert in: Steinzeit bei Schimpansen Müdigkeit zur rechten Zeit
![[RSS]](./theme/image/rss.png)